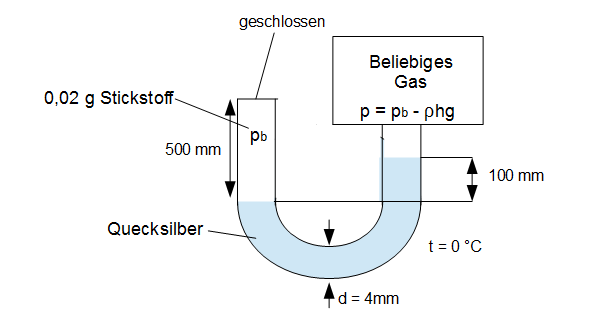
Gegeben sei wieder das in Anwendungsbeispiel 2 gegebene U-Rohr-Manometer, mit der mit Stickstoff gefüllten geschlossenen Säule.
Die Angaben sind der Grafik zu entnehmen.
Beispiel
Wie groß ist die Temperaturdifferenz des Stickstoffes?
Da die Druckänderung des Gases im Behälter vernachlässigt werden kann, kann man mittels der Gleichung für das U-Rohr den Bezugsdruck, also den Druck des Stickstoffes bestimmen:
$p = p_b - \rho \; h \; g$.
Das Minuszeichen wird wieder verwendet, weil der Druck des Stickstoffes größer ist als der des Gases im Behälter. Das sieht man wieder an der Höhendifferenz (siehe Kapitel Druck).
Der absolute Druck im Behälter lag im Anwendungsbeispiel 2 bei $p = 244.771,81 Pa$. Die Dichte von Quecksilber beträgt $\rho = 13.550 kg/m^3$. Es ist noch die Höhendifferenz zu bestimmen, welche sich nun durch die Ausdehnung des Stickstoffes um 20mm verändert hat.
Der Stickstoff breitet sich in der linken Säule um 20mm aus, d.h. der Spiegel des Quecksilbers sinkt um 20mm an der linken Säule. Das führt dazu, dass der Spiegel des Quecksilbers an der rechten Säule um genau diese 20mm erhöht wird. Die vorherige Höhendifferenz erhöht sich somit um $2 \cdot 20mm$ auf $h = 140 mm$.
$p = p_b - \rho \; h \; g$.
$244.771,81 Pa = p_b - 13.550 kg/m^3 \cdot 0,14 m \cdot 9,81 m/s^2 $
Methode
Nachdem nun der Bezugsdruck bestimmt wurde, kann die Temperaturdifferenz mittels der thermischen Zustandsgleichung bestimmt werden:
(1) $p_2V_2 = m \; R_i \; T_2$
(2) $p_1V_1 = m \; R_i \; T_1$
Es müssen diese beiden thermischen Zustandsgleichungen betrachtet werden und alle Größen, welche varriert werden (Temperatur, Volumen und Druck) mit Indizes versehen werden. Die Masse des Stickstoffes und die spezifische Gaskonstante bleiben gleich. Diese Gleichungen werden nun voneinander subtrahiert:
(1) - (2): $p_2V_2 - p_1V_1 = m \cdot R_i (T_2 - T_1)$.
In der Aufgabenstellung ist nach der Temperaturdifferenz die Frage, weshalb:
$T_2 - T_1 = \frac{p_2V_2 - p_1V_1}{m \cdot R_i}$
Der Druck $p$ ist hierbei der Bezugsdruck (Stickstoff), da dieser als ideales Gas angenommen wird. Der Bezugsdruck $p_2$ ist dabei der neue Bezugsdruck nach Erwärmung und $V_2$ das neue Volumen nach der Erwärmung.
Das neue Volumen berechnet sich durch die Ausdehnung um 20mm zu der bereits vorhandenen Höhe, welches der Stickstoff einnimmt:
$V_2 = (20mm + 500mm) \cdot \pi \cdot 2^2 = 6.534,51 mm^3 = 6.534,51 \cdot 10^{-9} m^3$.
Die Werte für $p_1$, $V_1$, $m$ und $R_i$ sind aus dem Anwendungsbeispiel 2 zu entnehmen:
$T_2 - T_1 = \frac{263.381,38 Pa \cdot 6.534,1 \cdot 10^{-9} m^3 - 258.064,36 Pa \cdot 6.283 \cdot 10^{-9} m^3}{2 \cdot 10^{-5} kg \cdot 296,8 \frac{J}{kg K}}$
Methode
Weitere interessante Inhalte zum Thema
-
Beispiel: U-Rohr-Manometer
Vielleicht ist für Sie auch das Thema Beispiel: U-Rohr-Manometer (Hydrostatik) aus unserem Online-Kurs Strömungslehre interessant.
-
Rohrleitungen mit Pumpen
Vielleicht ist für Sie auch das Thema Rohrleitungen mit Pumpen (Hydrodynamik) aus unserem Online-Kurs Strömungslehre interessant.