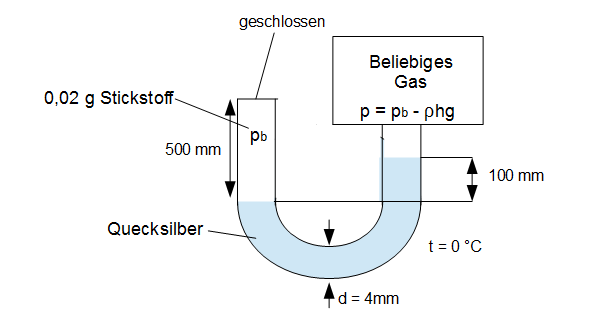
Die thermische Zustandsgleichung für ideale Gase stellt den Grenzfall aller thermischen Zustandsgleichungen für geringe Dichten ($longrightarrow$ geringe Drücke) und hohe Temperaturen dar. Dadurch können das Eigenvolumen der realen Gasteilchen sowie die Kohäsion (Anziehung) zwischen ihnen vernachlässigt werden. Möchten wir ein bestimmtes Gas betrachten, das sich annähernd ideal verhält, können wir auch andere Formen der allgemeinen Gasgleichung benutzen, in denen stoffspezifische Größen verwendet werden können oder deren Verwendung sinnvoll ist.
Die allgemeine Gasgleichung liegt in einer extensiven Form vor, die Zustandsgröße auf die sie sich bezieht, ist die Stoffmenge und mithin extensiv:
Methode
$ p \; V = n \; R_u \; T $
Die obige thermische Zustandsgleichung des idealen Gases beinhaltet die Stoffmenge $n$ und die universelle Gaskonstante $R_u$. Die Stoffmenge $n$ kann über die Masse und die Molmasse wie folgt berechnet werden:
Methode
$n = \frac {m}{M} $
Setzen wir für $n$ den obigen Zusammenhang ein, so erhalten wir die thermische Zustandsgleichung in der folgenden Form:
(1) $ p \; V = \frac {m}{M} \; R_u \; T $.
Teilen wir die universelle Gaskonstante durch die Molmasse $M$ des zu betrachtenden Gases, erhalten wir die spezifische oder individuelle Gaskonstante Ri.
Methode
$ R_i = \frac {R_u}{M} $ Spezifische Gaskonstante
Die individuelle Gaskonstante ist für jedes Gas verschieden.
Beispiel
Zum Beispiel beträgt die individuelle Gaskonstante von trockener Luft ($M = 0,0289644 \frac{kg}{mol}$) :
$R_{i,Luft} = \frac{8,31447 \frac {J}{mol \; K} }{0,0289644 \frac{kg}{mol}} = 287,058 \frac{J}{kg \; K}$
Wir können nun die obige Gleichung (1) wie folgt umstellen:
$ p \; V = m \; \frac{R_u}{M} \; T $
Und damit ergibt sich:
Methode
$ p \; V = m \;R_i \; T $
mit
$p$ - Druck des Gases in Pascal
$V$ - Volumen des Gases in m³
$m$ - Masse des Gases in g oder kg
$R_i = \frac{R_u}{M}$ - spezifische oder individuelle Gaskonstante in $ \frac {J}{kg \; K} $
$T$ - thermodynamische Temperatur des Gases in Kelvin
Die Stoffmenge n gibt an, wie viele Teilchen N (Atome, Moleküle, Ionen, Elektronen, andere Formeleinheiten) in einem System enthalten sind. Dazu wird die tatsächliche Teilchenzahl mit der Avogadro-Konstante NA multipliziert. Die Einheit der Stoffmenge ist Mol [1 mol].
$ N = n \cdot N_A \; \rightarrow \; n = \frac {N}{N_A} $
Soll mit der Teilchenzahl anstatt der Stoffmenge Berechnungen durchgeführt werden, so folgt aus:
$ p \; V = n \; R_u \; T $
Durch das Einsetzen von:
$ R_u = N_A \cdot k_B $
Ergibt sich:
$ p \; V = n \; N_A \; k_B \; T $
Einsetzen von:
$ n = \frac{N}{N_A} $
So erhält man die Form:
Methode
$ p \; V = N \; k_B \; T $
Teilt man das Volumen $V$ durch die Stoffmenge $n$ oder durch die Masse $m$ des betrachteten Gases, so erhält man die intensiven Formen der thermischen Zustandsgleichung idealer Gase. Gleiches gilt, wenn die Masse des Gases durch sein Volumen dividiert wird.
Methode
$ p \; V = n \; R_u \; T \; \rightarrow \; p \; v_m = R_u \; T $
$ p \; V = m \; R_i \; T \; \rightarrow \; p \; v = R_i \; T $
$ p \; V = m \; R_i \; T \; \rightarrow \; p = \rho \; R_i \; T $
mit:
$ v_m = \frac{V}{n} $ molares Volumen in $ \frac{l}{mol} $
$ v = \frac{V}{m}$ spezifisches Volumen in $ \frac{l}{g} $
$ \rho = \frac{m}{V}$ Dichte in $ \frac{g}{l} $
Weitere interessante Inhalte zum Thema
-
Beispiel 2: Thermische Zustandsgleichung idealer Gase
Vielleicht ist für Sie auch das Thema Beispiel 2: Thermische Zustandsgleichung idealer Gase (Aggregatzustände) aus unserem Online-Kurs Anorganische Chemie für Ingenieure interessant.
-
Carnot-Prozess
Vielleicht ist für Sie auch das Thema Carnot-Prozess (Thermodynamik) aus unserem Online-Kurs Physik interessant.