Inhaltsverzeichnis
Hinweis
In einem Phasendiagramm werden die Druck- und Temperaturbereiche, in denen Phasen in ihren Aggregatzuständen thermodynamisch stabil sind, grafisch dargestellt.
Die drei Aggregatzustände von chemischen Reinstoffen lassen sich somit durch Phasendiagramme veranschaulichen.
Merke
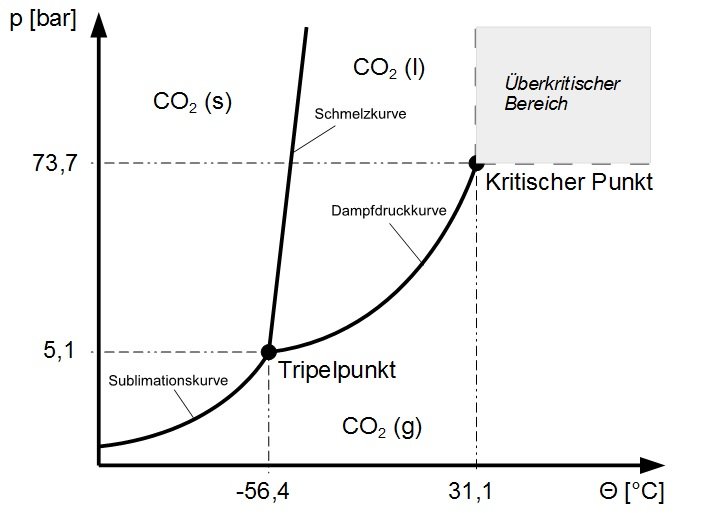
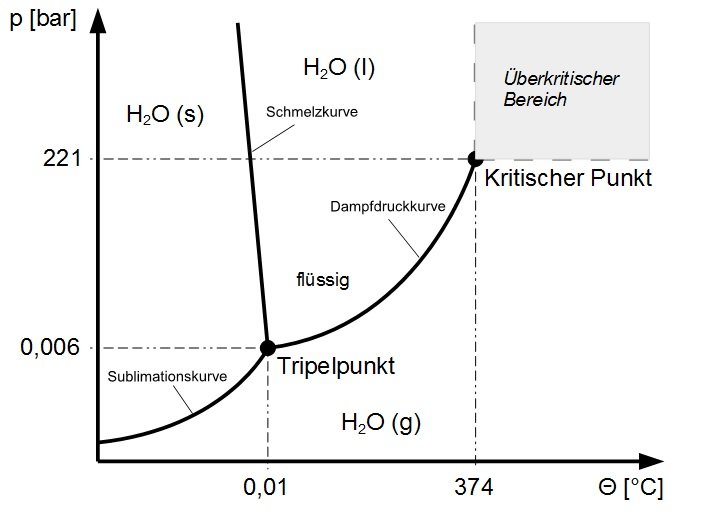
Am Tripelpunkt liegen die drei Aggregatzustände eines Stoffes im thermodynamischen Gleichgewicht vor. Bei dieser Temperatur und diesem Druck können alle drei Aggregatzustände existieren.
Die Dampfdruckkurve endet am kritischen Punkt. Ab hier sind der gasförmige und flüssige Zustand nicht mehr unterscheidbar. Oberhalb der kritischen Temperatur kann ein Gas auch durch beliebig hohen Druck nicht mehr verflüssigt werden.
Beispiele:
Kohlendioxid
Das Kohlendioxid ist ein Stoff, dessen Zustandsänderungen ein "normales" Verhalten zeigt. Wird der Druck auf flüssiges CO2 erhöht, so wird dieses fest. Das feste Kohlendioxid weist also eine höhere Dichte als seine Flüssigkeit auf.
Versuchsvideo: Überkritisches Abkühlen
In diesem Video kannst du sehen, wie überkritisches Schwefelhexafluorid wieder in den unterkritischen Bereich übergeht. Zu Beginn ist keine Phasentrennfläche zu erkennen. Beim Erreichen des kritischen Punktes trübt sich das SF6 stark ein und es bildet sich von unten beginnend wieder eine Phasentrennfläche aus, die die gasförmige und flüssige Phase trennt.
Versuchsvideo: Unterkritisches Erhitzen
In einer Druckküvette steht zu Beginn des Videos flüssiges Schwefelhexafluorid SF6 unter einem Druck, der knapp über seinem kritischen Druck (3,76 MPa = 37,6 bar) liegt. Seine Temperatur liegt knapp unter seiner kritischen Temperatur von 45,6 °C. Die Temperatur wird nun sehr vorsichtig erhöht. Der Flüssigkeitsstand nimmt mit steigender Temperatur zu. Wird die kritische Temperatur erreicht, verschwindet die Phasengrenzfläche, die flüssige und gasförmige Phase trennt. Ist die Grenzfläche vollständig verschwunden, liegt das SF6 im überkritischen Zustand vor, Gas und flüssige Phase lassen sich nicht unterscheiden. Oberhalb des kritischen Punkts lässt sich das SF6 auch durch noch so großen Druck nicht verflüssigen.
Wasser
Das Wasser zeigt in seinem Phasendiagramm ein annormales Verhalten. Wird bei gleichbleibender Temperatur Druck auf Wassereis ausgeübt, so kann es schmelzen. Dieses Verhalten wird auf verschiedene Weise ausgenutzt (z. B. Schlittschuhlaufen), bereitet aber auch technisch große Probleme (z. B. Frostschäden an Straßen). Da Wasser unter Normaldruck seine höchste Dichte bei circa 4 °C hat, wo es flüssig ist, kann Wassereis auf seiner Flüssigkeit schwimmen.
Weitere interessante Inhalte zum Thema
-
Phasendiagramme
Vielleicht ist für Sie auch das Thema Phasendiagramme (Aufbau mehrphasiger Stoffe) aus unserem Online-Kurs Werkstofftechnik 1 interessant.
-
Phasengemische
Vielleicht ist für Sie auch das Thema Phasengemische (Aufbau mehrphasiger Stoffe) aus unserem Online-Kurs Werkstofftechnik 1 interessant.