Inhaltsverzeichnis
Die Thermodynamik beschäftigt sich mit den Zustandsänderungen von Stoffen oder ganzen Systemen aufgrund von Wärmezufuhr oder -abfuhr. Deswegen wird sie auch häufig als Wärmelehre bezeichnet.
Merke
Wird einem System bzw. einem Körper Wärme zugeführt, so ändert sich seine Temperatur $T$ , sein Druck $p$ und sein Volumen $V$.
Die drei obigen Größen ($T$, $p$, $V$) stellen die thermischen Zustandsgrößen dar und werden in den folgenden drei Abschnitten eingeführt.
Beispiel
Als Beispiel für den Zusammenhang der obigen drei Zustandsgrößen (Temperatur, Druck und Volumen) können wir ein Quecksilberthermometer betrachtet. Der Stoff, welcher hier betrachtet wird, ist das Quecksilber. Steigt die Außentemperatur an, so ändert sich die Temperatur des Quecksilbers. Das führt dazu, dass sich das Quecksilber im Thermomenter ausdehnt, das Volumen vergrößert sich also. Aufgrund der Volumenzunahme nimmt auch der Druck zu.
Es ist also deutlich zu erkennen, dass die drei thermischen Zustandsgrößen voneinander abhängen. Bei der Betrachtung von Zustandsänderungen von Stoffen bzw. ganzen Systemen muss zwischen offenen, geschlossenen und isolierten Systemen unterschieden werden.
Abgeschlossenes/isoliertes System
Ein abgeschlossenes oder isoliertes System liegt vor, wenn keine Verbindung zur Umgebung vorhanden ist. Das bedeutet also, dass kein Stoff- und Wärmeaustausch mit der Umgebung möglich ist. Das System ist also vollständig von der Umgebung abgeschlossen bzw. isoliert. Solche Systeme sind in der Realität nicht gegeben, weil ein System nie vollständig von der Umgebung abgeschlossen ist. Allerdings kann man näherungsweise von isolierten Systemen ausgehen, wenn eine kurze Zeitspanne betrachtet wird.
Beispiel
Als Beispiel betrachten wir eine Thermoskanne, die mit heißen Tee gefüllt ist. Wir schließen die Thermoskanne luftdicht ab. Es kann also kein Stoffaustausch stattfinden. Für eine gewisse Zeit kann man hier auch davon ausgehen, dass keine Wärme zwischen Thermoskanne und Umgebung übertragen wird. Der Tee in der Thermoskanne ändert also seine Temperatur nicht, weil keine Wärme an die Umgebung abgegeben wird. Dann handelt es sich um ein isoliertes System.
Auf längere Sicht hingegen wird der Tee irgendwann die Temperatur der Umgebung annehmen. Tatsächlich erfolgt hier also ein Wärmeaustausch zwischen Thermoskanne (=System) und der Umgebung.
Geschlossenes System
Bei einem geschlossenen System ist kein Stoffaustausch mit der Umgebung möglich. Ein Wärmeaustausch findet hingegen mit der Umgebung statt.
Beispiel
Wir betrachten dieses mal keine Thermoskanne, sondern eine Glaskeraffe, welche wir oben luftdicht verschließen können. Es findet demnach kein Stoffaustausch mit der Umgebung statt. Allerdings sind nun die Glaswände nicht mehr wärmeisoliert. Das bedeutet also, dass der heiße Tee in der Kanne Wärme an die Umgeung abgeben kann. Der Tee wird also sehr schnell die Temperatur der Umgebung annehmen.
Offenes System
Ein offenes System ermöglicht sowohl die Stoff- als auch die Wärmeübertragung mit der Umgebung.
Beispiel
Füllen wir den heißen Tee in eine Tasse, so führt das Verdamfen des Tees dazu, dass Stoff an die Umgebung übertagen wird. Außerdem findet ein Wärmeaustausch mit der Umgebung statt. Der Tee gibt solange Wärme an die Umgebung ab, bis die Umgebung und der Tee die selbe Temperatur aufweisen.
Weitere interessante Inhalte zum Thema
-
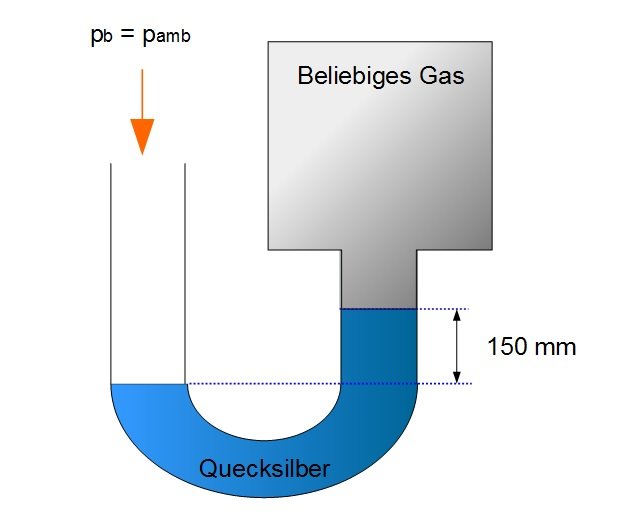
Beispiel: U-Rohr-Manometer
Vielleicht ist für Sie auch das Thema Beispiel: U-Rohr-Manometer (Hydrostatik) aus unserem Online-Kurs Strömungslehre interessant.