Anorganische Chemie
Dein Vollzugriff auf ingenieurkurse.de
Mache ingenieurkurse.de zu deinem Begleiter in deinem Studium oder deiner Aus- und Weiterbildung.
Vollzugriff auf alle Online-Kursesowie alle zukünftigen Erweiterungen und laufende Aktualisierungen
Alle Lernmaterialien komplettmit mehr als 500 Videos, 5120 interaktiven Übungsaufgaben und 3100 Lerntexten
Günstiger als bei Einzelbuchungnur 14,90 € monatlich bei 12 Monaten Mindestvertragslaufzeit
JETZT BUCHEN für 14,90 € monatlich
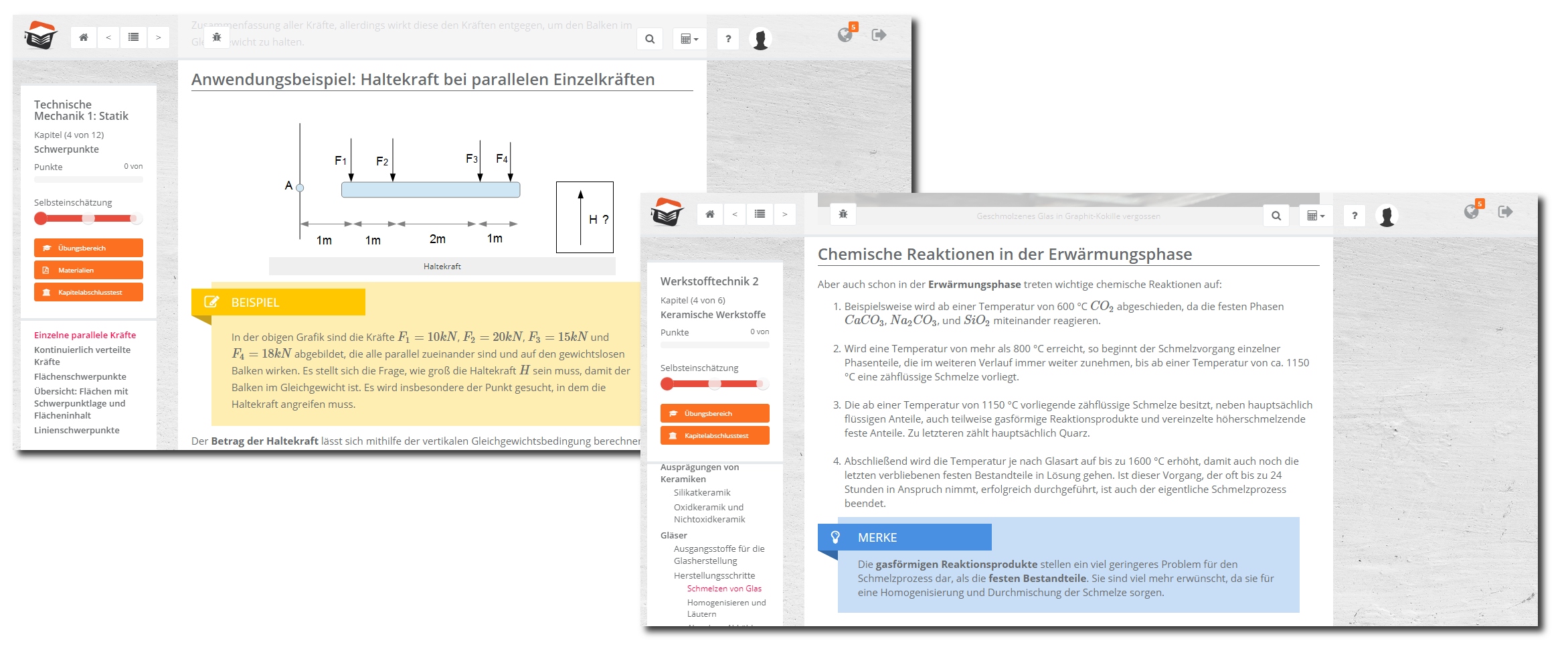
Die Anorganische Chemie ist ein elementares Studienfach in Ihrem Ingenieursstudium. Dieser Kurs ist daher so konzipiert, dass Ihnen die Lehrinhalte besonders anschaulich vermittelt werden.
Themen:
Im Eingangskapitel werden wir Sie mit den Grundlagen der Anorganischen Chemie vertraut machen. Anhand von Definitionen und Anschauungsbeispielen erlernen Sie ein Grundverständnis für die Chemie und für physikalische Gegebenheiten. Wir klassifizieren u.a.homogene und heterogene Stoffe, die Aggregatzustände sowie Phasendiagramme und Systemkomponenten.
Im Kapitel Aggregatzustände vertiefen wir die Thematik und gehen auf den gasförmigen Zustand, die t hermischen Zustandsgleichungen, unterschiedliche Gas-Gesetze und viele weitere Themen ausführlich ein.
Anschließend führen wir Sie, unterstützt durch anschauliche Lehrbeispiele und Übungsaufgaben, in das Thema Elemente des Periodensystemsein. Dabei behandeln wir nacheinander den Atomaufbau, die Elementarteilchen, das Schalenmodell,Orbitalmodell, Hauptquanten, Nebenquanten, Magnetquanten undSpinquanten. Danach folgen in diesem Kapitel die Themen Hauptgruppen und Nebengruppendes Periodensystems der Elemente. Abschließend erfolgt in diesem Kapitel eine Einteilung der Elemente in Metalle und Nichtmetalle sowie eine Beschreibung der Stoffeigenschaften hinsichtlich Elektronegativität, Ionisierungsenergie und Elektronenaffinität. .
Im Kapitel Chemisches Rechnen liegt das Augenmerk besonders auf den Grundrechenarten der Chemie. Wir erklären Ihren detailliert wie Sie die Stoffmenge, Molare Masse und Konzentration berechnen. Zudem erlernen Sie mit uns wie chemische Reaktionen zerlegt werden können, eine Reaktionsgleichung aufgestellt wird und wie diestöchiometrische Zahl zu bestimmen ist. Nach den Gesetzen der Chemie folgt ein besonders ausführliches Beispiel zum Aufstellen einer Reaktionsgleichung.
Nach den Themen Reaktionsenergie, Reaktionsenthalpie und dem Satz von Hess, folgen die umfangreichen Abschnitte chemisches Gleichgewicht und Chemie in Industriemaßstäben.
Die Bindungsarten sowie deren Bindungslänge und Bindungsstärke sind dann Thema des nächsten Kapitels. Wir stellen Ihnen die Schreibweise nach Lewis und die Bindungsbildung mit Valenzelektronen vor. Danach folgen zuerst die starken Bindungsarten und abschließend die schwachen Bindungsarten.
Im abschließenden Kapital dieses Kurses erläutern wir Ihnen intensiv die Thematik des Donator-Akzeptor-Prinzips. Hierbei beginnen wir mitSäuren und Basen und stellen Ihnen alle notwendigen Vorgänge und Gesetzmäßigkeiten vor. Anschließend folgen die Themen Ampholyte, Ionenprodukt, pH-Wert, Neutralisation, Säure-Base-Puffer sowie viele weitere kapitelbezogene Themen.
Nach der einfachen Betrachtung der Säuren und Basen erfolgt zum Ende diese Kapitels die Redox-Chemie.
Nach Abschluss dieses Kurses werden Sie gut vorbereitet sein und können beruhigt in die Klausur gehen.
Vorteile im Überblick
-
Über 90 Dokumente und mehr als 170 Übungen vermitteln Ihnen umfassend alles Wissenswerte.
Im Kurs sind darüber hinaus 27 Videos enthalten, in denen die wichtigsten Themen anschaulich zusammengefasst werden. Insgesamt knapp 1 Stunden Videomaterial steigern Ihren Lernerfolg und sorgen nebenbei für Abwechslung.
- Schon mehrere tausend Kursteilnehmer haben sich für unsere Online-Kurse entschieden. Wir haben über viele Jahre Erfahrungen gesammelt und unsere Kursoberfläche stetig verbessert.
- Das Internet bietet Ihnen weitreichende Möglichkeiten: Lernen, wann und wo Sie möchten. Und daneben gibt es bei uns zahlreiche Features, die zum schnelleren und besseren Lernerfolg beitragen.
Diese Themen werden behandelt
Bitte auf Kapitelüberschriften klicken, um Unterthemen anzuzeigen
Anorganische Chemie
-
Grundlagen der Chemie
-
Aggregatzustände
-
Elemente des Periodensystems
-
Chemisches Rechnen, Grundrechenarten
-
Bindungsarten, Bindungsstärke und Bindungslänge
-
Donator-Akzeptor-Prinzip
39,00 €
- 95 ausführliche Lerntexte
- 27 verständliche Videos
- 170 Aufgaben zum Üben
- 125 prägnante Schaubilder
Unsere Online-Kurse basieren auf einem erprobten Lernkonzept,
welches erfahrene Dozenten für dich entwickelt haben
Lernvideos
Lerntexte
Übungsaufgaben
Webinaren
Leicht verständliche Lernvideos
Profitieren Sie von einem umfassenden didaktischen Konzept! Sichern Sie sich das kompakte Wissen in den Online-Kursen mit Grundlagentexten, Lernvideos und tausenden interaktiven Übungen. Unsere Dozenten erklären Ihnen in hunderten Lernvideos die schwierigsten Themen leicht verständlich & kompakt.
- Vertiefung der schwierigsten Themen in hunderten Lernvideos
- anschauliche Erklärungen
- perfekte Ergänzung zu den Lerntexten